Un fantasma evanescente, un lampo di bianco appena pennellato di nero sulla punta delle ali, un’anima evanescente persa tra le nuvole e sferzata dal vento, accecante contro dune desertiche dorate, sopra campi verdi macchiati di rosse gocce di papaveri in primavera… un incontro che regala sempre emozioni, che forse sarà solo un ricordo in futuro o un sogno per pochi, è l’Albanella pallida, il rapace venuto dall’est.

In quello che ormai sembra un remoto passato, l’Albanella pallida Circus macrourus era davvero molto comune, tanto da essere considerata in Italia da i due grandi ornitologi Arrigoni degli Oddi (1929) e Martorelli (1960) come la più frequente tra le albanella.
Nel giro di alcuni decenni, il numero di coppie nidificanti in Europa ha subito un drammatico e inesorabile declino, tanto da raggiungere l’estinzione in gran parte dei paesi europei (Hagemeijer & Blair 1997), diventando assai rara anche nei maggiori siti per lo studio della migrazione dei rapaci nel paleartico (Corso, 2005, Corso & Cardelli, 2004, Shirihai et al. 2000).
La popolazione mondiale è stimata oggi in 18,000- 30,000 coppie, nella Lista Rossa degli uccelli IUCN/BirdLife è considerata NT (Near Threatened), ossia potenzialmente minacciata (http://datazone.birdlife.org/species/factsheet/22695396).
La specie nidifica principalmente nelle aree steppiche e semi steppiche della Russia meridionale e del Kazachistan, nel Mar Nero orientale e pochissimi siti della Turchia, a est sino al Yenisey e Altai. Circa il 60-80% della popolazione mondiale è localizzata nel sud-est Russo e nel Kazachistan settentrionale. Alcune stime complessive del recente passato parlavano di una diminuzione di oltre il 20-30% della popolazione dal 1990 al 2000 (Burfield & van Brommel, 2004, BirdLife), ma più di recente la reale consistenza della popolazione e il suo trend vengono ritenuti sconosciuti o poco circostanziabili (BirdLife, 2021).
Il suo potenziale declino generale, è stato principalmente attribuito alla degradazione e antropizzazione dell’habitat di riproduzione, all’agricoltura intensiva con conseguente distruzione e perdita di habitat idonei, diminuzione delle prede e contaminazione da pesticidi tossici sia nei siti di nidificazione che nei quartieri di svernamento (Burfield & van Brommel, 2004, BirdLife International, 2009, 2021, Terraube et al. 2009).
Se la perdita di habitat per ragioni diverse può essere un fattore certamente significativo, soprattutto sino ai primi anni ‘90, non si deve dimenticare ed escludere il disastro di Chernobyl che ha certamente fortemente influito sullo stato di salute generale sia degli habitat che delle popolazioni animali di tutta l’area asiatica ed europea (Henny et al. 1998, Jonsson et al. 1999 Ellegreen et al. 1997). In effetti, un percorso e un destino molto simile lo hanno subito le altre specie a rischio estinzione presenti nel Paleartico Occidentale, ossia il Chiurlottello (Numenius tenuirostris) (forse già estinto) e la Pavoncella gregaria (Vanellus gregarius), che presentano areali ampiamente sovrapponibili a quelli dell’Albanella pallida (e all’area fortemente interessata dall’inquinamento radioattivo conseguente al disastra nucleare citato).
Allo stesso modo, il declino di specie quali Aquila delle steppe e Sparviere levantino è stato altresì attribuito in parte all’inquinamento radioattivo (Yosef & Fornasari, 2004). Studi recenti (Terraub et al. 2009) ed in corso (Corso & Kamp in prep.) mostrano però come dal 2001 si iniziano a raccogliere dati positivi che sembrano indicare una ripresa di alcune popolazioni di Albanella pallida, in particolar modo quelle russe e kazache. Infatti, a seguito del collasso delle politiche agricole russe, migliaia di ettari di campagne sono state abbandonate, quindi non più intensivamente sfruttate e coltivate, lasciando così innumerevoli appezzamenti incolti ed idonei alla riproduzione della specie. Questo probabile trend positivo, pare in effetti riflettersi sull’aumento visibile nel numero di individui osservati annualmente in Italia, nonché in altri paesi europei, dove ha anche iniziato a nidificare con poche coppie, sparse e localizzate (es Finlandia, Olanda, Germania) (EBN Italia, varie fonti).
Svernamento
Gli areali principali di svernamento sono due: India (Afghanistan, Pakistan, India, Sri Lanka, Nepal, Bangladesh e Myanmar) e Africa sub-sahariana centro-meridionale (Sudan, Eritrea, Gibuti, Etiopia, Somalia, Kenya, Uganda, Ruanda, Burundi, Tanzania, Malawi, Zambia, Zimbabwe, Mozambico, Ciad, Niger, Mali, Senegal, Gambia, Sierra Leone, Guinea-Bissau, Liberia, Costa d’Avorio, Ghana, Togo, Benin, Burkina Faso, Nigeria, Camerun, Repubblica Centro Africana, Repubblica Democratica del Congo, Angola, Namibia, Botswana, Swaziland e Sudafrica). Alcune decine di individui svernano anche in Medio Oriente, sui Balcani, in Turchia, in Nord Africa ed eccezionalmente in Europa mediterranea, principalmente in Italia e soprattutto Sicilia (Corso & Cardelli, 2004; Corso, 2005, Terraube et al. 2009). L’areale di svernamento tunisino, ritenuto importante da moltissimi autori (Corso & Cardelli, 2004) viene invece considerato marginale da studi più recenti (Isenman et al. 2005) e osservazioni personali (oss. pers.).
Migrazione
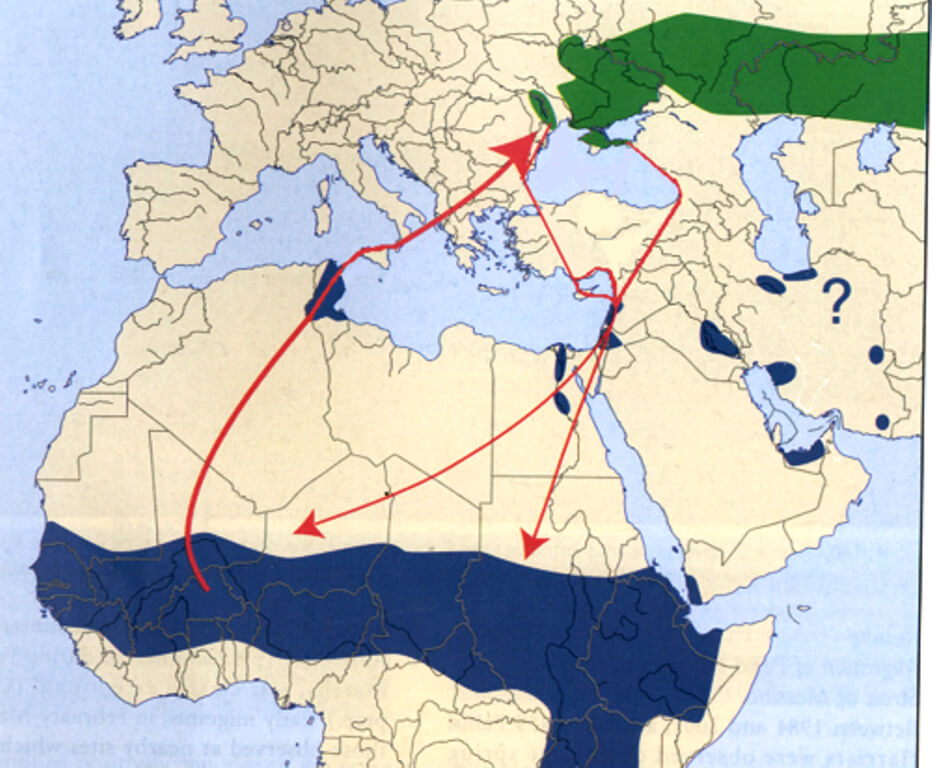
Le principali rotte di migrazione si trovano a Batumi, in Georgia (http://www.batumiraptorcount.org), Kirwan et al. 2008), in Turchia, principalmente orientale (Kirwan et al. 2009), in Medio Oriente (es. Sinai e Israele – Shirihai et al. 2000, Corso & Cardelli, 2004.), in Iran (Ullman & Ullman, rif. pers.) (Fig.1) e pochi altri siti. In Europa centrale e settentrionale la specie è alquanto rara, osservata principalmente in paesi quali la Finlandia (dove sono anche noti casi di ibridazione con Albanella reale e minore, Forsman, 1999, 2019; Forsman, com. pers.), la Svezia, l’Inghilterra, mentre risulta accidentale in Europa occidentale (Onrubia et al. 2009).
In territorio europeo, normalmente è più facile osservarla durante la migrazione pre-riproduttiva (marzo-aprile). Meno frequente durante quella post-riproduttiva (settembre-novembre), sebbene in molti paesi dell’Europa settentrionale capiti più di frequente in periodo autunnale invece che primaverile.
IN ITALIA
Nel nostro paese l’Albanella pallida è un migratore regolare scarso, più comune e abbondante durante i movimenti pre-riproduttivi, da febbraio a maggio, con picco a fine marzo-inizio aprile (adulti, principalmente maschi) e fine aprile-inizio maggio (molti giovani). Svernante irregolare con alcune decine di segnalazioni in periodo invernale (Corso & Cardelli, 2004, Corso, 2005, Brichetti & Fracasso, 2003). Annualmente vengono osservati 100-200+ individui su territorio nazionale. Il sito dove osservarla con maggiore facilità e certezza è senza dubbio lo Stretto di Messina; da qui infatti passa una delle principali rotte di migrazione di tutto il Paleartico occidentale (Corso & Cardelli, 2004). Qui, nell’ambito dei campi per lo studio e la salvaguardia della migrazione del WWF-MAN, dal 1999 al 2009 sono state censite lungo il versante siciliano dello stretto ben 771 albanelle pallide, quindi in media 70 individui per ogni campo studio (aprile-maggio), con un massimo di 132 nel 2001, anno record in Italia in epoca “moderna” (Corso & Cardelli, 2004, Corso, 2005).
Durante tutti questi anni di studio del passaggio pre-riproduttivo, è stato visto con certezza come il 96% dei maschi adulti passi in marzo-aprile, principalmente entro la prima metà del mese di aprile, il 75% delle femmine in aprile ma con un 25% che si osserva sino a maggio ed un picco di passaggio più tardivo rispetto ai maschi adulti, mentre i giovani hanno due picchi, uno entro la prima metà di aprile, ed un altro a fine aprile-maggio.
Osservazioni effettuate a Messina in febbraio-marzo evidenziano un passaggio quasi esclusivo di maschi adulti, con pochissime femmine e giovani (Corso, 2005, Giordano, Ricciardi, Adami, Cardelli, et al. ined.). Dalle osservazioni dei soci di EBN Italia (www.ebnitalia.it), questa fenologia relativa a sesso-età viene ulteriormente confermata, con una predominanza netta di maschi in febbraio-inizio aprile (Annuari EBN Italia 2003-2008 – Ruggieri, 2003,2004,2005, Ruggieri & Sighele, 2007, 2008, Ruggieri & Nicoli, 2009). Dati che confermano quanto già segnalato in letteratura da tutti gli autori (Gustin & Pizzarri, 1998, Yosef, 1996, Shirihai et al. 2000, Corso, et al. 2009).
RICONOSCIMENTO IN NATURA
Come per le altre albanella il riconoscimento dei maschi non comporta problemi, ma nel caso delle femmine e dei giovani è necessario uno studio molto dettagliato ed approfondito, e solo l’occhio allenato ed esperto riuscirà a distinguerli dai giovani e femmine di Albanella reale e minore. Qui di seguito riporto solo dei cenni generali segnalando i caratteri più importanti:

Silhouette e volo
Contrariamente a quanto riportato nella grande maggioranza delle guide per il riconoscimento, la struttura e quindi la silhouette dell’Albanella pallida è assai più simile a quella dell’Albanella reale (Circus cyaneus) piuttosto che dell’ Albanella minore (Circus pygargus). A parte il maschio, snello e slanciato, la femmina e il giovane in effetti mostrano una corporatura più massiccia della pygargus, con ala più larga, mano che sembra meno appuntita rispetto a questa specie, in virtù della diversa formula alare (P10 più corta), coda più corta e ampia come nella cyaneus, testa massiccia da “gufo”, corpo pesante e “muscoloso”. Dunque, molto simile all’Albanella reale, dalla quale però si distingue per sole 4 “dita” ben visibili in volo sulla punta dell’ala (primarie esterne digitate), coda comunque leggermente più lunga, ala ampia con profilo inferiore spesso ad S in virtù delle secondarie ampie e concave ma la mano molto appuntita, meno ampia e rotondeggiante che in cyaneus (quest’ultima ha infatti 5 “dita”, ossia 5 primarie esterne ben digitate). Il volo è potente e diretto, con battiti alari molto profondi, decisi, e potenti, basso sul terreno durante la caccia e con repentine e brusche virate e cambiamenti di direzione, quasi da falcone.

Nell’Albanella minore il volo è più da gabbiano o sterna, molto elastico con battiti fluidi ed eleganti, molto aggraziati, volo più oscillante e meno diretto, più erratico, caccia al suolo in genere in maniera meno potente e con andatura più esitante, spesso ad altezza dal suolo superiore, con improvvise impennate e ricadute sul terreno sulla preda, inseguendo meno i passeriformi in volo come un falco. L’ Albanella reale ha invece un volo più pesante e diretto della minore e molto simile alla pallida, ma durante la caccia è meno veloce e meno falconiforme che la pallida, avendo un metodo di caccia molto simile alla minore ed al Falco di palude.
- Maschio: molto facile da riconoscere, presenta un piumaggio quasi evanescente, tutto bianco argenteo con dorso e testa più grigiastro cenerino chiarissimo. La testa e la gola essendo più cenerini, meno bianco puro, formano un piccolo cappuccio vagamente più scuro e contrastante con le parti inferiori. Sulla punta dell’ala si apprezza come una pennellata di nero, essendo il nero molto ristretto rispetto ai maschi delle altre specie, avendo contrariamente a questi le primarie esterne (una o due: P10 soltanto oppure P10-P9 – contando a decrescere dall’esterno verso l’interno) bianche o grigio sporco ma non nere, mentre le successive tre-quattro o quattro e mezzo nere (P9-P6 oppure P9-P5 oppure P8-P5). Le copritrici sopracaudali sono bianche barrate di grigio, il groppone è grigio e non con bianco come nella reale. La coda è grigia di varia intensità, e con una serie di barrature ben visibili da sotto ma meno marcate superiormente, in alcuni individui le barrature risultano quasi non visibili mentre in altri sono più marcate, di norma la più vistosa è quella (sub) terminale. Non presenta barrature vistose sulle remiganti come nella minore, solo un vago accenno di barra terminale più grigiastra, e un variabile numero di strette ed irregolari barrature o marezzature sulle secondarie, in genere più marcate e visibili nei maschi immaturi e meno adulti.

- Femmina: molto simile davvero alla minore e soprattutto alla reale, se ne distingue principalmente per: 1) tipo di volo e silhouette (come descritto su); 2) secondarie più offuscate e scure rispetto ad adulti di minore e reale, con barratura chiara meno visibile e meno ampia; 3) collarino certamente più ampio, pulito e visibile che in minore, molto simile invece nella reale, soprattutto nei maschio giovani; 4) formula alare differente; 5) bordo scuro alla “mano” (primarie interne) assai meno ampio e meno marcato che in minore, spesso quasi non visibile in natura cosicché la mano sembra mancare di bordatura scura, e sembra più pulita e contrastante con secondarie; 6) striatura sulle parti inferiori differente, con cappuccio e petto più striati e quindi qui scuri, ben contrastanti con restanti parti inferiori meno pesantemente stiate, in minore striatura più omogenea e diffusa.

- Giovane: molto simile al giovane di minore, si distingue principalmente per: 1) volo differente e struttura più massiccia; 2) collare chiaro intorno al collo più ampio, marcato, più pulito e più visibile in natura; 3) ancora più importante, il tipico e distintivo “boa” scuro intorno al collo, che demarca nettamente il collare chiaro e che rispetto alla minore e alla reale è decisamente più solido, più scuro, più ampio e ben visibile sul campo; 4) bordo terminale scuro alle primarie interne meno nerastro e dunque meno marcato e visibile che in minore, essendo più traslucido e più chiaro delle altre barrature sulle primarie (più ampio e marcato però nelle femmine, quindi maggiormente simili a pygargus); 5) “dita”, quindi primarie esterne, meno estesamente nere in media rispetto ai giovani di minore (variabile); 6) bande nere su timoniere più ampie che in minore e reale, quindi spesso un’unica banda chiara visibile da sotto; 7) tarsi più lunghi di minore, ben visibile la differenza quando gli animali sono posati, con postura più orizzontale e alta sulle “gambe”

NB: tutti i caratteri su menzionati si riferiscono a classi di età ben definite e quindi al maschio adulto tipico, alla femmina adulta tipica e al giovane fresco. Tutti i piumaggi di pallida, reale e minore transizionali (sia di età che di stagione) non vengono qui discussi, poiché esulerebbero dagli intenti di una semplice pubblicazione divulgativa.
Bibliografia
BirdLife International (2021) Species factsheet: Circus macrourus. Downloaded from http://www.birdlife.org on 01/06/2021. Recommended citation for factsheets for more than one species: BirdLife International (2021) IUCN Red List for birds. Downloaded from http://www.birdlife.org on 01/06/2021.
Brichetti P. & Fracasso G. 2003. Ornitologia Italiana. Vol. I Gaviidae- Falconidae. Alberto Perdisa Editore, Bologna, Italia.
Burfield, I., & van Brommel, F. 2004. Birds in Europe: Population estimates, trends and conservation status. BirdLife Conservation Series No. ? BirdLife International, Cambridge.
Corso, A. 2001. Raptor migration across the Strait of Messina, southern Italy. Brit. Birds94: 196-202.
Corso, A. 2005. Avifauna di Sicilia, L’EPOS, Palermo, 322 pp.
Corso, A. in prep. Further comments on migration and wintering of Pallid Harrier in Central Mediterranean and North Africa.
Corso, A. & Kamp, J. in prep. Trends of Pallid Harrier in Western Palearctic.
Corso, A., Janni, O., Larsson, H., Viganò M & Gustin, M. 2009. First data on migration of raptors at the Pelagie islands, Sicilian channel. ALULA (n. spec.): atti XV CIO.
Corso, A., Biasioli, M, Scatassi, N. & Gagliardone, M. in prep. Raptors migration over Southern Sinai. Sandgrouse.
Ellegreen H, Lindgren G, Primmer CR and Moller AP 1997. Fitness loss and germline mutations in barn swallows breeding in Chernobyl. Nature 389: 593–596
Forsman, D. 1999. The Raptors of Europe and the Middle East: A Handbook of Field Identification. Poyser, London.
Gustin, M., Pizzari, T. 1998. Migratory pattern in the genus Circus: sex and age differential migration in Italy. – Ornis svecica, 8: 23-26.
Hagemeijer, E. J. M., & Blair, M. J. (eds.). 1997. The EBCC Atlas of European Breeding Birds: Their Distribution and Abundance. Poyser, London.
Henny CJ, Galushin VM, Dudin PI, Khrustov AV, Mischenko AL, Moseikin VN, Sarychev VS and Turchin VG 1998. Organochlorine pesticides, PCBs, and mercury in hawk, falcon, eagle and owl eggs from the Lipetsk, Voronezh, Novgorod and Saratov regions, Russia, 1992–1993. Journal of Raptor Research 32: 143–150.
Isenmann, P., Gaultier, T., El Hili, A., Azafzaf H., Dlensi H. & Smart, M. 2005. Oiseaux de Tunisie. Seof, France. Pp. 432.
Kirwan, G., Boyla, K., Castell, P., Demirci, B., Özen, M., Welch, H. & Marlow, T. 2008. The Birds of Turkey. A&C Black.
Jonsson B, Forseth T and Ugedal O 1999. Chernobyl radioactivity persists in fish. Nature 400: 417
Onrubia, A, Munòz, A-R., Forsman, D., Ramirez, J & De la Cruz, A. 2009. Presenzia inusual de rapaces migradores orientales en el Estrecho de Bibraltar. Migres 1 : 47-54.
Ruggieri, L. (red.), 2003. Annuario 2003. Edizioni EBN Italia.
Ruggieri, L. (red.), 2004. Annuario 2004. Edizioni EBN Italia.
Ruggieri, L. (red.), 2005 annuario 2005. Edizioni EBN Italia.
Ruggieri, L & Sighele, M. (red.).2007. Annuario 2006. Edizioni EBN Italia. Verona, pp. 48.
Ruggieri, L. & Sighele, M. (red.).2008. Annuario 2007. Edizioni EBN Italia. Verona, pp. 48
Ruggieri, L. & Nicoli, A. (red.).2009. Annuario 2008. Edizioni EBN Italia. Verona, pp. 44
Shirihai, H., Reuven, Y., Alon, D., Kirwan, G. & Spaar, R. 2000. Raptor migration in Israel and the Middle East. A summary of 30 years of research. Eilat: IBRC & IOC.
Yosef, R. 1996. Sex and age classes of migrating raptors during the spring 1996 at Eilat, Israel. J. Raptor Res. 30: 160-164.
Yosef, R. and Fornasari, L. 2004. Simultaneous decline in Steppe Eagle (Aquila nipalensis) populations and Levant Sparrowhawk (Accipiter brevipes) reproductive success: coincidence or a Chernobyl legacy? Ostrich, 75: 20-24.



